
Регистрация товаров, поступающих на рынок РФ, является обязательной процедурой, которая позволяет подтвердить их безопасность и качество для потребителей. Однако это достаточно сложный процесс, требующий глубоких знаний в области законодательства, профессиональных навыков в сфере проведения лабораторных испытаний и умения грамотно оформить всю необходимую документацию. Особое значение имеет регистрация медицинских изделий, поскольку это оказывает прямое влияние на здоровье населения.
Наша компания готова предложить грамотную поддержку в области регистрации медицинских изделий. На протяжении длительного периода времени мы осуществляем тесное взаимодействие с ведущими специалистами Росздравнадзора, которые следят за всеми обновлениями нормативной документации и в состоянии обеспечить индивидуальный подход к каждому клиенту.
Нужна регистрация медицинского изделия в Росздравнадзоре? Обратившись в ООО «ЕЦЭС КВОЛИТИ», вы можете рассчитывать на оперативное проведение экспертизы, получение корректных результатов и профессиональное оформление разрешительной документации. Благодаря солидному опыту работ с зарубежными партнерами, в нашей компании проводится не только регистрация медицинских изделий в России, но и регистрация иностранных товаров мед назначения.
В этой статье мы подробно расскажем, как проводится государственная регистрация медицинских изделий на территории нашей страны и в евразийском экономическом союзе. Также вы познакомитесь с основными этапами и правилами проведения данной процедуры.
Что такое государственная регистрация медицинских изделий?
Регистрация мед изделий и медтехники представляет особой государственную процедуру, обязательную к прохождению всеми производителями и юридическими лицами. Ее основной целью является предоставление жителям РФ высококачественной и безопасной продукции медицинского назначения. Основным нормативным документом регистрации мед изделий служит Постановлением Правительства РФ от 27 декабря 2012 г. N 1416 «Об утверждении Правил государственной регистрации медицинских изделий».
В нашей стране допускается обращение мед товаров, которые успешно прошли регистрацию, при участии соответствующего органа власти в соответствии с постановлением Правительства РФ.
При этом под вышеуказанной техникой и изделиями подразумеваются оборудование, инструментарий, приборы и материалы, предназначенные для решения тех или иных медицинских задач. Следует учитывать, что использоваться они могут как по отдельности, так и при сочетании с аналогичной продукцией.
Кроме того, к числу товаров медицинского назначения относятся:
- Компьютерные программы, разработанные специально для проведения диагностики, профилактических процедур и лечебных мероприятий, а также реабилитации пациентов и мониторинга их состояния в после реабилитационный период;
- Изделия, предназначенные для предотвращения беременности и проведения абортов, которые обладают высокой эффективностью по сравнению с другими медицинскими препаратами.
Особенности регистрации медицинских изделий в РФ
Постановлением Правительства РФ от 27 декабря 2012 г. N 1416 устанавливаются требования к процедуре государственной регистрации продукции медицинского предназначения. Эти правила регулярно изменяются, что является проблематичным для большинства изготовителей и дистрибьюторов товаров медицинского назначения, так как отследить все нововведения бывает невозможно для многих участников рынка.
Очередные дополнения в порядок регистрации медицинских изделий в России были утверждены Постановлением Правительства РФ от 31 мая 2018 г. N 633. Существенное влияние на данную процедуру оказывают поправки, связанные с регулированием функций Росздравнадзора и подотчетных ему юридических лиц, занимающихся экспертной оценкой.
Например, не так давно были изданы Методические рекомендации, касающиеся проведения регистрации медицинских изделий. Они непосредственно связаны с экспертизой, выполняемой для определения эффективности, качества и безопасности товаров данной направленности.
Мы отслеживаем любые нововведения в юридической сфере, и принимаем их во внимание при сборе документации для наших заказчиков.
Этапы регистрации медицинских изделий в России

- Подготовка плана формирования регистрационного досье;
- Прохождение изготовителем испытаний, подтверждающих возможность действенного и безопасного применения продукта. В отношении товаров, входящих в 1 категорию риска, на этом шаге выполняются клинические испытания;
- Формирование пакета документов в рамках регистрационного досье и отправка его, наряду с заявкой, на прохождение регистрационной процедуры, в уполномоченный надзорный орган;
- Сотрудники Росздравнадзора изучают полученные документы с целью оценки правильности их составления и достаточности комплекта. Период рассмотрения регистрационного досье не превышает 5 рабочих дней.
При отсутствии недочетов и ошибок в представленном комплекте материалов, специалисты надзорного органа назначают I этап экспертизы качества и безопасного применения товара. Этому процессу подлежат только те продукты, которые входят в классы риска 2а, 2б и 3.
Первый этапа государственной регистрации медицинских изделий
Реализация I этапа экспертизы происходит под руководством специализированной структуры, деятельность которой находится в ведении Росздравнадзора. В процессе него экспертные специалисты изучают содержание представленных документов, чтобы оценить возможность направления медицинских изделий на исследования. При выявлении существенных недочетов, выполнение регистрационной процедуры становится невозможным. На этот процесс экспертам предоставляется 20 рабочих дней. На основании выводов специалистов составляется экспертное заключение, которое направляется в надзорный орган.

В испытаниях участвует уполномоченная организация, осуществляющая медицинскую деятельность, внесенная в особый реестр Росздравнадзора. Сведения, полученные в процессе исследований, фиксируют в протоколе и отправляют в надзорный орган. Период выполнения клинических испытаний не учитывается при определении общей продолжительности регистрационной процедуры.
После этого сотрудники Росздравнадзора анализируют результаты проведенной исследовательской деятельности и, в случае вынесения положительного решения, назначают II этап экспертной оценки.
Квалифицированные специалисты ООО «ЕЦЭС КВОЛИТИ» осуществляют подготовку комплекта документов, необходимых для выполнения регистрационной процедуры. Также мы оказываем содействие при подаче документов для реализации исследовательской деятельности.
Второй этапа экспертиза качества
II этапа экспертизы выполняется уполномоченным органом для медицинских изделий всех категорий независимо от класса риска. В процессе него сотрудники данной организации оценивают сведения, полученные в процессе исследовательской деятельности, в отношении конкретного товара. На эту процедуру предусмотрено около 10 рабочих дней. На основании результатов проведенного анализа составляется экспертное заключение, которое в дальнейшем направляется в Росздравнадзор.

На следующем шаге осуществляется оформление регистрационного удостоверения, а информация о предоставлении документа фиксируется в Едином реестре, опубликованном на сайте Росздравнадзора.
В постановлении 1416 «Об утверждении Правил государственной регистрации медицинских изделий» установлены сроки выполнения регистрационного процесса. Так, общая продолжительность процедуры регистрации медицинских изделий, включая сбор всех необходимых документов, не превышает 50 рабочих дней. Но в этот период не входит срок, необходимый для реализации исследовательской деятельности, поскольку она может иметь отличительные особенности с учетом характеристик медицинских изделий.
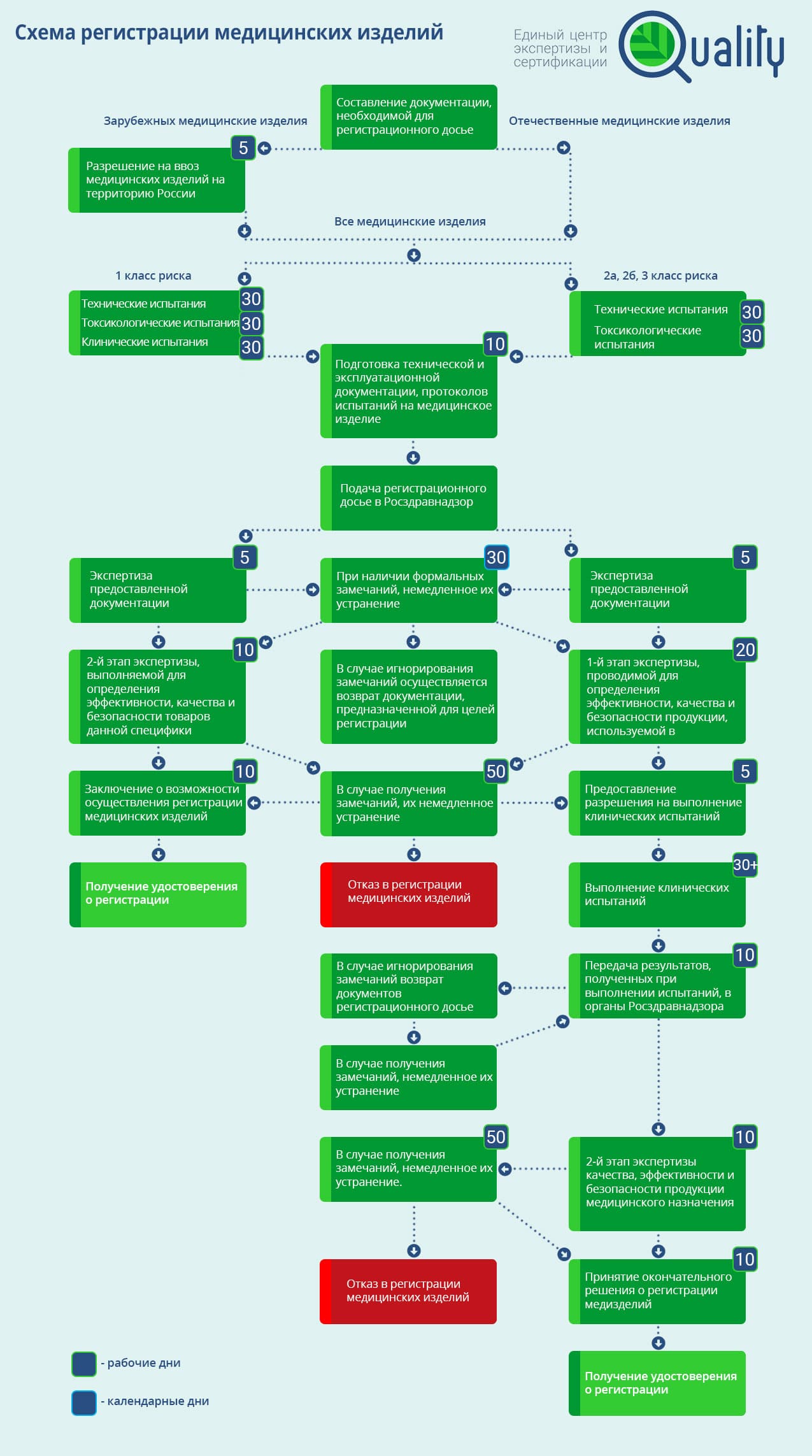
Схема регистрации медицинских изделий
Руководствуясь желанием оказать поддержку всем участникам рынка, далее мы представим схему регистрации медицинских изделий, в рамках которой учитывается все дополнения и поправки.
Какими правилами руководствоваться при регистрации в РФ и ЕАЭС?
В данный момент государственная регистрация медицинских изделий пребывает в «переходном состоянии»: требования ЕАЭС вступят в законную силу с 31 декабря 2021 года. При этом основополагающим фактором считается то, что при прохождении товаром медицинской специфики вышеуказанной регистрационной процедуры, Заявитель может получить отказ в предоставлении документа, подтверждающего регистрацию. Это обусловлено завершением действия правил РФ и внедрением правил ЕАЭС.
То есть, если вам требуется регистрация медицинских изделий или услуги, мы советуем не затягивать с выполнением данной процедуры, что позволит учесть все установленные сроки перехода.
СМК при регистрации медицинских изделий

Принимая во внимание Постановление №136, для выполнения регистрационной процедуры в отношении изделий класса потенциальной опасности 2а, подвергшихся стерилизации, и остальных продуктов категории риска 2б и 3, следует ввести систему менеджмента качества при осуществлении производственного процесса и произвести внеплановую проверку. Но, в соответствии с Постановлением №135, обойти инспекцию при участии государственных надзорных органов можно на протяжении 9 месяцев после обретения законной силы. То есть, до 1 июня 2023 года у изготовителей присутствовала возможность пройти регистрационный процесс в отношении продуктов высокой потенциальной опасности и изделий 2а категории риск, без обязательного выполнения проверок на соответствие требованиям СМК.
С 1 июня 2023 года государственные проверки производственных мощностей новых изделий высокого класса опасности и продукции категории риска 2а, подлежащей стерилизации, будут осуществляться в обязательном порядке. Более того, за это время планируется внести дополнения или изменения в регистрационное досье.
По результатам ввода и использования СМК на медицинские изделия достигаются следующие преимущества:
- Сокращение расходов на производственную деятельность;
- Постоянный контроль и минимизация любых отклонений от ожидаемого результата;
- Увеличение производительности;
- Четкое выполнение мероприятий по защите труда;
- Минимизация вероятности возникновения аварийных и чрезвычайных ситуаций из-за неудовлетворительного качества техники, предназначенной для медицинских целей;
- Оптимальный расход ресурсов и т.д.
Также, за счет наличия ИСО 13485 достигаются высокая конкурентоспособность при:
- При выборе инвесторов;
- Проведении конкурентных торгов;
Контроле, обеспечиваемом уполномоченными структурами, и в других случаях.
Правила регистрации медицинских изделий
На территории РФ разрешается обращение товаров медицинского назначения, которые ранее были зарегистрированы соответствующим исполнительным органом. При этом регистрация медтехники и медоборудования регламентируется Федеральным законом «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323-ФЗ.
Регистрация медоборудования предполагает соблюдение определенных требований, которые устанавливаются Правительством РФ от 27.12.2012 № 1416.
В рамках правил регистрации медицинских изделий обязательным и необходимым является получение следующих услуг:
- Прохождение технических исследований (для всех медицинских товаров);
- Изделия, которые впоследствии будет контактировать с человеческим организмом, подвергаются токсикологическим испытаниям;
- Для утверждения типа средств измерений проводятся испытания (их список устанавливается Министерством здравоохранения РФ);
Прохождение клинических исследований (для всех медицинских изделий).
Медицинские изделия подлежащие государственной регистрации
Оборудование медицинского назначения:
- Техника, предназначенная для хирургических и косметологических целей;
- Аппаратура, используемая при проведении диагностики (УЗИ, рентген и т.д.);
- Оборудование для in vitro диагностики;
- Аппараты, применяемые в процессе лабораторных исследований;
- Приспособления для реабилитации (роботизированные протезы, инвалидные кресла и т.п.);
- Устройства, предназначенные для терапевтических целей;
- Оборудование стоматологического назначения;
- Аппараты для поддержания жизнедеятельности;
- Изделия медицинской специфики, используемые для вживления в организм;
- Другое оборудование, применяемое в медицинской сфере.
В перечень медицинских изделий, подлежащих регистрации, также входят следующие товары:
- Инструменты, используемые в процессе выполнения оперативных вмешательств;
- Расходники (фильтры, реагенты и т.д.);
- Изделия общебольничного назначения (специальная одежда, бахилы и др.);
- Материал для выполнения хирургических швов;
- Средства для осуществления перевязок пациентам;
- Инструментарий для проведения осмотра;
- Предметы мебели, предназначенные для медицинский целей;
- Ортезы;
- Другие приспособления медицинской специфики.
Специализированные программы:
- Программы, предназначенные для целей телемедицины;
- Компьютерные программы, позволяющие выполнить анализ диагностических снимков;
- Программное обеспечение, обеспечивающее контроль информационной базы медицинских центров;
- Другие программы, используемые для решения медицинских задач.
Перечень медицинских изделий подлежащих государственной регистрации >
Документы необходимые при регистрация медицинских изделий

Основанием для начала процедуры регистрации медицинских изделий служит само заявление. Когда регистрация изделий медицинского назначения осуществляется в России, следует подготовить следующий комплект документов:
- ОГРН, ИНН;
- Выписку из Единого государственного реестра юридических лиц;
- Документ международного образца, который свидетельствует о наличии на предприятии действующей CMK;
- Доверенность, свидетельствующая о праве выступать в интересах заявителя (заверенная нотариусом);
- Документ, устанавливающий требования технического характера (ТУ);
- Документация, свидетельствующая о присутствии производственных мощностей;
- Свидетельство о проведении квалификационной проверки;
- Описание товара, подлежащего процедуре регистрации;
- Технические инструкции;
- Фотографии продукции медицинского назначения.
Для иностранных товаров:
- Регистрационное удостоверение изготовителя (в стране производства);
- Документация, свидетельствующая об условиях изготовления товара медицинского предназначения;
- Документы разрешительного характера на продукцию, подлежащую регистрации;
- Технические файлы;
- Доверенность на лицо, представляющее интересы производителя в России;
- Инструкция по использованию;
- Фотографии товаров медицинской сферы, подлежащей регистрации.
Сроки регистрации медицинских изделий

Если вам требуется регистрация медицинского изделия, мы готовы оказать квалифицированную помощь в данном направлении. Возможность экономии времени обеспечивается за счет того, что наши специалисты по регистрации медицинских изделий осуществляют некоторые этапы регистрации медицинских изделий в параллельном режиме. Это ускоряет процесс и повышает нашу конкурентоспособность на фоне остальных компаний, оказывающих подобные услуги.
Чаще всего, процесс регистрации продукции медицинской специфики занимает следующие сроки:
- 1 класс – полгода;
- 2а класс и 2б класс – около 10 месяцев;
- 3 класс – приблизительно 1 год.
Госпошлина и стоимость проведения лабораторных исследований и испытаний

Стоимость государственной пошлины за проведение экспертизы качества эффективности и безопасности медицинского изделия определяется категорией риска, в которую входит то или иное изделие. Например, если выполняется регистрация медицинских изделий 3-го класса, то госпошлина оплачивается 115 000 рублей.
Регистрация медицинских изделий:
- Для 1-го класса — 72 000,00 рублей;
- класс 2а — 104 000,00 рублей;
- класс 2б — 136 000,00 рублей;
- класс 3 — 184 000,00 рублей.
Проведение испытаний с целью государственной регистрации медицинских изделий, является одним из самых важных этапов работы, к которому можно приступить только после окончательной разработки технической и эксплуатационной документации на регистрируемое медицинское изделие.
- Стоимость токсикологических испытаний — 12 000 рублей за один материал или пигмент;
- Испытания на Электромагнитную совместимость — 50 000 рублей (только для активных медицинских изделий);
- Технические испытания — в зависимости от ГОСТов и Стандартов, на основании которых разрабатывается медицинское изделие — от 50 000 рублей;
- Стерилизация в автоклаве и паровая (для изделий, которые выпускаются нестерильными, но должны пройти стерилизацию перед использованием) — от 10 000 рублей;
- Валидация процесса стерилизации — от 50 000 рублей;
- Клинические исследования — от 50 000 рублей.
Преимущества регистрации медицинских изделий с ЕЦЭС КВОЛИТИ

Где найти помощь если нужна регистрация медицинского изделия? ООО «ЕЦЭС КВОЛИТИ» в течение длительного времени сотрудничает с ведущими сотрудниками Росздравнадзора, что позволяет нам отслеживать обновления всей юридической документации и внимательно относиться к требованиям каждого заказчика.
Обратившись в ООО «ЕЦЭС КВОЛИТИ», каждый клиент может рассчитывать на оказание всех необходимых услуг в сфере регистрации медицинской продукции. Мы готовы обеспечить профессиональное документальное сопровождение и грамотную консультацию при возникновении любых сопутствующих вопросов.
В услуги регистрации медицинских изделий нашей компании входят:
- Проверка и внесение изменений в сопроводительную документацию;
- Квалифицированная поддержка на всех этапах лабораторных исследований;
- Создание досье на все товары оздоровительного назначения;
- Сбор документации на начальной стадии проведения экспертизы;
- Грамотная юридическая консультация в течение всего процесса регистрации.
В ходе предоставления регистрационных услуг мы занимаемся оформлением всех заключений и документов, подтверждающих безупречное качество и возможность безопасного использования продукции заказчика. При этом от заявителя требуется лишь предоставить образцы изделия и основные документы в рамках процесса регистрации.
Презентации ведущих руководителей в сфере регистрации медицинских изделий
- Федеральная служба по надзору в сфере здравоохранения — Антонов В.С.: «Общие требования безопасности и эффективности медицинских изделий как основа обращения медицинских изделий на территории Евразийского экономического союза»
- Федеральная служба по надзору в сфере здравоохранения — Астапенко Е.М.: «Новеллы нормативно-правового регулирования в сфере обращения медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Ахтямова Э.И,: «Внедрение системы менеджмента качества в рамках Евразийского экономического союза. Инспектирование производства медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Валеева А.А.: «Особенности проведения клинических испытаний медицинских изделий в целях регистрации в рамках Евразийского экономического союза»
- Национальный Центр Экспертизы «Войнован Д.А.: «Процедура регистрации медицинских изделий в рамках евразийского экономического союза»
- Федеральная служба по надзору в сфере здравоохранения — Дорофеев А.А.: «Практика применения проверочных листов при проведении контрольно-надзорных мероприятий в сфере обращения медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Живлова О.В.: «Процедура внесения изменений в документы, содержащиеся в регистрационном досье медицинского изделия»
- Федеральная служба по надзору в сфере здравоохранения — Мигеева М.А.: «Актуальные вопросы организации контрольно-надзорных мероприятий в сфере обращения медицинских изделий в свете риск-ориентированного подхода»
- ФГБУ «ВНИИИМТ» РОСЗДРАВНАДЗОРА — «Никифорова Л.Ю.: «Порядок проведения технических испытаний и исследований с целью оценки биологического действия медицинских изделий»
- ФГБУ «ВНИИИМТ» РОСЗДРАВНАДЗОРА — «Никифорова Л.Ю.: «Типичные нарушения, выявляемые при проведении экспертизы качества, эффективности и безопасности медицинских изделий»


