
Для того чтобы реализация изделий, предназначенных для медицинских целей, осуществлялась на законных основаниях, необходимо выполнить их регистрацию в государственных органах. Однако при некомпетентном подходе и участии малоопытных специалистов в подготовке к данной процедуре, могут возникать неоправданные риски и ошибки, что повлечет значительное затягивание сроков ее проведения и необходимость в повторном обращении в государственные органы. О подобных «подводных камнях» известно опытным производителям медицинских товаров, что объясняет их стремление иметь дело только с проверенными специализированными организациями.
Компания ЕЦЭС КВОЛИТИ на протяжении многих лет осуществляет сотрудничество со специалистами Росздравнадзора, что позволяет нам быть в курсе любых изменений в области законодательства и обновлений в сфере подготовки документации к включению в Государственный реестр. Обратившись к нам, каждый заказчик может рассчитывать на обеспечение поддержки в течение всего процесса регистрации: грамотная проверка сопроводительных документов, сопровождение во время проведения испытаний товара и возможность проведения профессиональной юридической консультации по всем моментам, связанным с данной процедурой.
Из этой статьи вы узнаете, что входит в перечень медицинских изделий, подлежащих государственной регистрации, познакомитесь с особенностями и этапами вышеуказанного процесса, а также сможете изучить наименования товаров, которые не включены в данную категорию.
или позвоните нам
МСК: +7 499-350-48-69
СПб: +7 812-309-89-10
Какие товары входят в группу медицинских изделий?

Медицинские изделия, подлежащие обязательной регистрации, представлены различными технические приспособлениями, оборудованием, материалами и устройствами аналогичного предназначения. Также к числу медицинских относятся товары, применяемые одновременно с непрофильной продукцией, например, компьютерными программами.
При этом в рамках толкования данного закона и в соответствии со ст.38, существуют следующие виды деятельности, которые относятся к числу медицинских целей:
- Проведение диагностических процедур, выполнение обследований, контроль функционирования важных систем и органов организма;
- Осуществление лечебных мероприятий, направленных на устранение дисфункции, замену компонентов тела, изменение его функциональных особенностей, а также выполнение аборта;
- Регенерация естественных процессов в организме, проведение реабилитационных процедур;
- Профилактические меры, позволяющие предупредить возникновение патологий и травматизации, а также исключающие возможность незапланированной беременности.
Основным фактором, указывающим на разницу между медизделиями и другой продукцией медицинского назначения, является метод влияния на человеческий организм, который исключает применение генетических, иммунологических, фармакологических и метаболических подходов. Иначе его следует отнести к разряду лекарственных средств или других продуктов, контроль использования которых на территории РФ осуществляется в соответствии с отдельной нормативно-правовой документацией.
Медицинские изделия, не требующие регистрации
Большинство медицинских товаров должно подвергаться государственной регистрации в обязательном порядке. Однако, существует продукция, которая не подлежит данной процедуре. Согласно постановлению № 1416, в эту группу входят изделия медицинского назначения, предназначенные для конкретного пациента. Их производство осуществляется по назначению врача для устранения последствий травмы или восстановления организма при наличии заболевания в индивидуальном порядке.
В Росздавнадзоре можно найти подробные разъяснения, касающиеся этого момента. Там представлена информация о том, что к числу медицинских изделий, не подлежащих государственной регистрации, относятся комплексы, которые предназначены только для транспортировки товаров диагностического, профилактического и лечебного назначения
Принцип формирования медицинских изделий, подлежащих регистрации

Таким образом, продукция медицинской специфики, предназначенная для массового использования, должна быть поставлена на учет в государственных органах в обязательном порядке. Сегодня в 65-ти государствах мира применяется номенклатура GMDN (Глобальная номенклатура медицинских изделий), созданная в Великобритании. Она способствует правильной организации данного процесса.
Сложность использования вышеуказанной классификации в нашей стране связана с различными подходами к деятельности рынка медицинских товаров, а также специфическими особенностями здоровья населения. Следовательно, для проведения более достоверной разбивки продукции медицинского предназначения, используемых в стране, был издан Приказ Минздрава РФ от 6 июня 2012 г. № 4н. В него включен утвержденный перечень медицинских изделий, подлежащих государственной регистрации.
Но проблема внедрения отечественной концепции учета не была окончательно урегулирована. Поэтому, для ее решения специалисты Росздравнадзора в 2014 году посетили Агентство Глобальной номенклатуры медицинских изделий в Великобритании. После проведения переговоров в области классификации медтоваров и обсуждения основных моментов, связанных с этим процессом, было получено важное разрешение. Сотрудникам из РФ был предоставлен доступ к данным номенклатуры GDMN, в которую включено большое количество названий продуктов, имеющих непосредственное отношение к данной сфере.
После изучения всей необходимой информации, наши специалисты смогли внести поправки в приказ № 4н. Благодаря этим изменениям, подходы к классификации товаров медицинской специфики, применяемые в РФ и других странах мира, были приведены в соответствие.
или позвоните нам
МСК: +7 499-350-48-69
СПб: +7 812-309-89-10
Перечень медицинских изделий, подлежащих регистрации
В настоящее время перечень медицинских изделий, подлежащих регистрации в Росздравнадзоре, включает 28926 названий товаров данной категории. Они подразделяются на 19 групп, в соответствии с целевым назначением.
| № | Категория медизделий | Специфика применения |
| 1 | Товары респираторного и анестезиологического назначения | Изделия, используемые для перевозки, изучения и кондиционирования сред, и имеющие форму пара или газа, что позволяет их применять для поддержания дыхательных процессов или осуществления обезболивания |
| 2 | Товары общебольничного или дополнительного назначения | Изделия, направленные на сохранение гигиенических условий в учреждениях медицинской сферы и предназначенные для обеспечения должного ухода за пациентами |
| 3 | Гастроэнтерологические товары | Продукты, участвующие в лечебных мероприятиях и оперативных вмешательствах, проводимых в области ЖКТ |
| 4 | Изделия, предназначенные для гинекологической и акушерской сферы | Товары, применяемые для устранения патологий в области женской половой системы, а также широко используемые для пациенток во время вынашивания ребенка, родовой деятельности и проведении восстановительных мероприятий в послеродовом периоде |
| 5 | Товары для ИВД | Изделия, участвующие в проведении исследований вне организма под контролем врача |
| 6 | Изделия, участвующие в регенерации органов и тканей | Продукция, предназначенная для выполнения оперативных вмешательств, исследовательской деятельности, а также восстановлении функционирования организма, его органов и систем |
| 7 | Продукты, имеющие отоларингологическое назначение | Медизделия, используемые при осуществлении диагностических процедур, а также лечебных мероприятий, направленных на устранение патологий в области лор-органов |
| 8 | Продукция, используемая в сфере косметологии, пластической хирургии и дерматологии | Товары, играющие важную роль при устранении и минимизации дефектов тканей при помощи специальных лекарственных средств, оборудования и хирургических приспособлений |
| 9 | МИ нейрологического назначения | Изделия, участвующие в диагностических и лечебных процедурах, направленных на устранение патологий нервной системы |
| 10 | Изделия ортопедического направления | Товары, предназначенные для профилактических целей, диагностирования и устранения патологий костно-мышечной системы |
| 11 | Товары офтальмологического предназначения | Продукты, используемые в профилактических, диагностических и лечебных целях, при наличии травм и дефектов в области органов зрения |
| 12 | Продукты радиологического назначения | Медизделия, участвующие в диагностических и лечебных манипуляциях, связанных с ионизирующим воздействием на человеческий организм и реабилитацией после него |
| 13 | МИ для инвалидов реабилитационного характера | Продукты, участвующие в диагностировании и устранении дефектов, и используемые для людей с ограниченными возможностями |
| 14 | Сердечно-сосудистые МИ | Товары, предназначенные для выявления, профилактики и устранения сердечно-сосудистых заболеваний, а также оказания экстренной помощи в случае критических ситуаций, связанных с ними |
| 15 | Изделия для стоматологической сферы | Продукция, участвующая в профилактических и лечебных мероприятиях, связанных с патологическими состояниями полости рта |
| 16 | Урологические изделия | Товары, разработанные для устранения патологий мочеполовой системы у мужчин |
| 17 | Медтовары для физиотерапевтических целей | Позиции для восстановления и лечения с использованием компонентов искусственного или естественного характера |
| 18 | Приспособления хирургического назначения и аналогичные системы | Продукты, участвующие в оперативных вмешательствах |
| 19 | Товары для эндоскопических целей | Изделия для эндоскопических процедур |
Этапы государственной регистрации медицинских изделий в Росздравнадзоре?

Услуга по государственной регистрации предоставляется в соответствии с положениями, указанными в приказе Минздрава № 737н. Она подразумевает выполнение следующих последовательных шагов:
- Подачу заявления и соответствующей сопроводительной документации. Изучение документов с целью подтверждения необходимости того, что могут быть проведены клинические испытания продукции;
- Оценка методов, последовательности и итогов клинических исследований, выполненных производителем в отношении заявленного товара медицинского предназначения;
- Составление заключения относительно вероятности осуществления тестирования медизделий. Выполнение исследований;
- Получение и оценка сведений о выполненных исследованиях, позволяющих удостовериться в эффективности и безопасности предоставленных образцов товара;
- Оформление заключительного решения о внесении в реестр медицинских изделий, подлежащих обязательной регистрации, составление сопутствующей документации и отправка их заказчику.
Классификация медицинских изделий по степени опасности
В соответствии с приказом Минздрава № 4н (Приложение № 2), существует 4 класса товаров медицинской специфики, которые отличаются по степени потенциальной опасности, возникающей в процессе использования каждого из них. К их числу относятся:

• Класс 1. Изделия, в процессе применения которых может возникать небольшая степень опасности;
• Класс 2а. Товары, в процессе использования которых имеет место риск средней степени;
• Класс 2б. Продукция, эксплуатация которой может вызвать значительный уровень опасности;
• Класс 3. Изделия, процесс использования которых сопровождается высокой степенью опасности.
Чтобы определить класс опасности Росздравнадзор использует следующие показатели:
• Длительность применения продукции;
• Инвазивная специфика его использования;
• Непосредственная связь с человеческим организмом во время применения;
• Возможность оперативного вмешательства для доступа изделия в организм;
• Насколько жизненно важным является система или орган, для которого используется продукт.
Реестр медицинских изделий, подлежащих обязательной регистрации
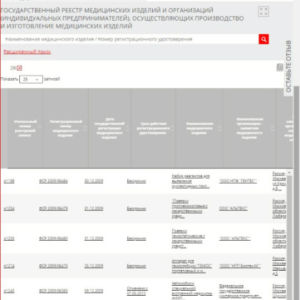
Сведения, выявленные в рамках предоставления услуги по регистрации, с учетом информации о классе опасности, подлежат внесению в Государственный реестр. Его составляют сотрудники. Росздравнадзора с указанием данных об изделиях медицинского предназначения и их изготовителях. На основе вышеуказанных сведений, каждый заинтересованный может отследить законность желаемого товара в текущий период времени.
Процесс занесения продукции медицинского предназначения в Государственный реестр является обязательным для многих позиций. Однако, для взаимодействия с государственными структурами необходима тщательная подготовка, что позволит избежать любых ошибок, рисков и затягивания регистрационной процедуры.
или позвоните нам
МСК: +7 499-350-48-69
СПб: +7 812-309-89-10

